Регистрация лекарственных средств: документы, порядок, возможные проблемы

1. Какие лекарства нужно регистрировать?
Регистрировать необходимо все лекарства, которые производятся и/или ввозятся на территорию Украины.
Не нужно регистрировать только лекарства, которые изготовляются:
- в аптеках по рецептам врачей (магистральным формулам);
- по заказу лечебно-профилактических заведений (по официальным формулам).
2. Документы, необходимые для регистрации лекарства
Перечень документов, необходимых для регистрации лекарства зависит от того, что это за лекарство, и собирается ли заявитель регистрировать активный фармацевтический ингредиент (АФИ) или действующее вещество, содержащееся в нем, одновременно с регистрацией этого лекарства. В зависимости от этого различают три вида заявлений о регистрации и, соответственно, три перечня документов, которые к ним прилагаются (при этом конкретный перечень документов также зависит от вида лекарства и условий его регистрации: во многих случаях некоторые из нижеперечисленных документов не нужны).
| Заявление по форме №1 СКАЧАТЬ |
Заявление по форме №2 СКАЧАТЬ |
Заявление по форме №3 СКАЧАТЬ |
| Используется для регистрации лекарственных средств, в том числе, иммунобиологических препаратов по полной процедуре |
Используется для регистрации традиционных лекарств и лекарств, которые производятся по утвержденным прописям |
Используется для регистрации АФИ или действующего вещества лекарства |
|
Перечень прилагаемых документов:
|
Перечень прилагаемых документов:
|
Перечень прилагаемых документов:
|
Для проведения экспертизы, на основании заявления, письма-направления и рекомендаций Минздрава, заявитель должен подать регистрационное досье на лекарство. Регистрационное досье в зависимости от вида лекарства и рекомендаций Минздрава может подаваться в одном из двух форматов: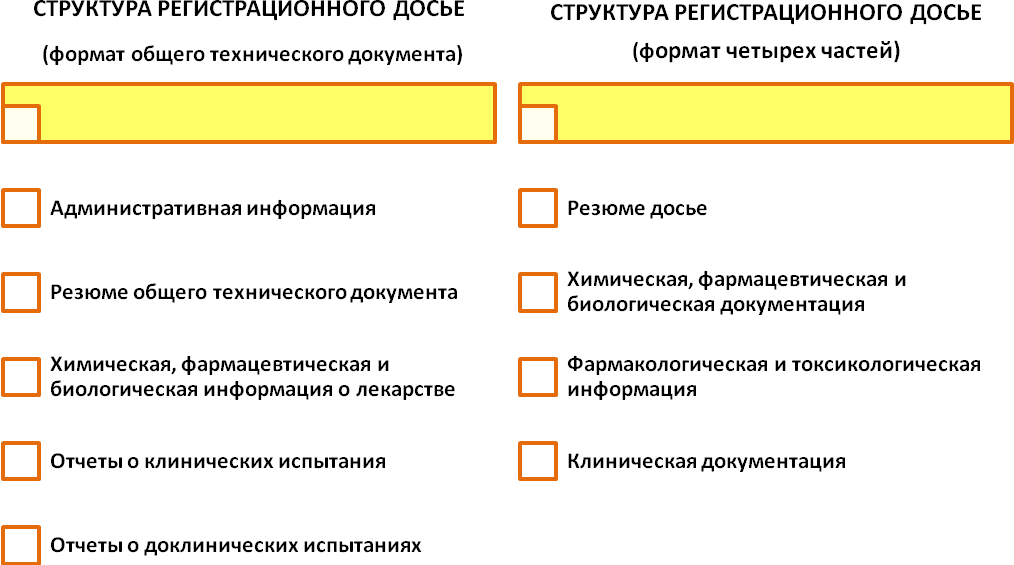
3. Порядок регистрации
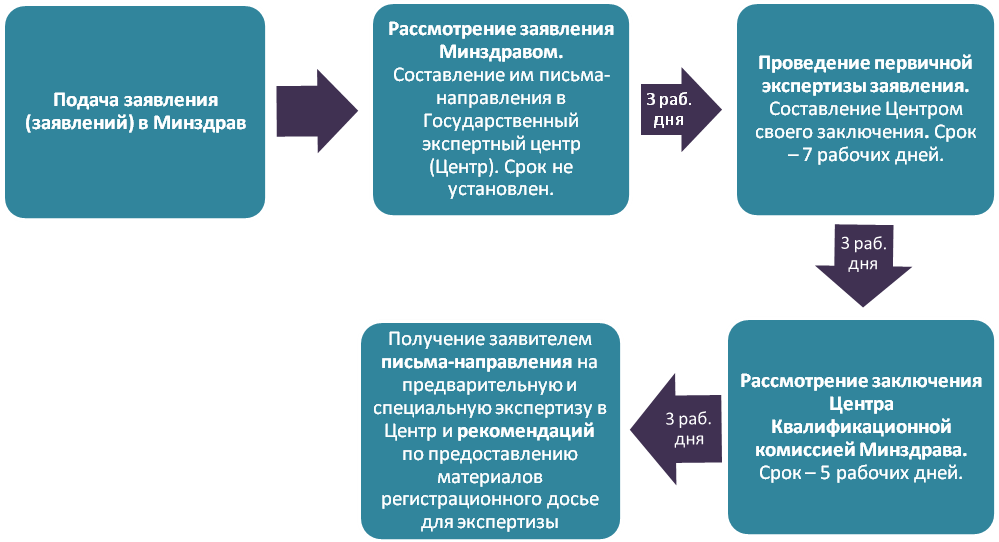
3.1. Подача заявления и его проверка
Возможные проблемы:
- задержки со сроками рассмотрения и передачи документов от Минздрава в Центр, из Центра в Минздрав, от Минздрава – заявителю;
- отказ в регистрации лекарства по причине внесения его в перечень лекарств, запрещенных к использованию;
- установление факта несоответствия заявления установленным требованиям;
- предоставление Минздравом заключения о необходимости предоставления заявления другого типа.
3.2. Подготовка и проведение экспертиз лекарства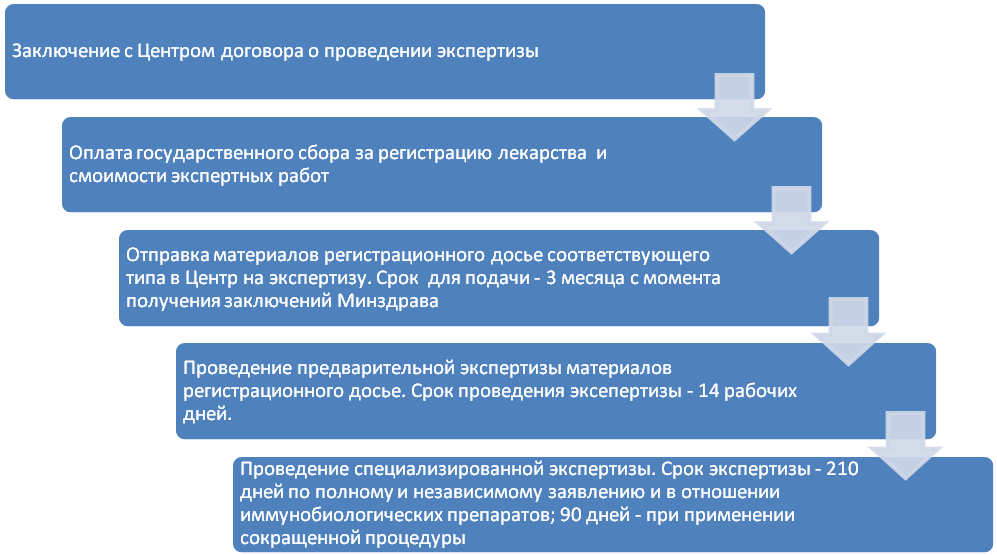
Возможные проблемы:
- продление сроков проведения предварительной экспертизы при необходимости предоставить дополнительные данные и/или информацию (срок предоставления дополнительных материалов – 90 рабочих дней);
- назначение дополнительных испытаний и/или дополнительной экспертизы (оплачиваются отдельно);
|
! |
Время, необходимое для подготовки и представления дополнительных данных и/или информации, а также для проведения дополнительных испытаний (экспертиз) не входит в срок проведения предварительной экспертизы. |
-
отказ в регистрации лекарства.
а) просрочка срока подачи материалов регистрационного досье на экспертизу;
б) несоответствие материалов регистрационного досье установленным требованиям;
в) непредоставление в установленный срок дополнительных материалов и/или информации;
|
! |
При отказе в регистрации лекарства регистрационный сбор и стоимость экспертных работ не возвращаются. |
- получение отрицательного заключения по результатам специализированной экспертизы и, как следствие, отказ в регистрации.
Основания:
а) лекарство вредно для здоровья и/или его терапевтическая эффективность отсутствует;
б) состав лекарства не соответствует заявленному;
в) материалы регистрационного досье не соответствуют установленным требованиям;
г) установлено факт неправомерного использования или ссылки на информацию относительно эффективности и безопасности референтного/оригинального лекарства, содержащего то же действующее вещество, в течение первых 5 лет с даты регистрации такого лекарства;
д) вследствие регистрации будут нарушены защищенные патентом действующие имущественные права интеллектуальной собственности.
3.3. Выдача регистрационного удостоверения


Возможные проблемы:
-
задержка сроков выдачи регистрационных документов
-
отправка проектов документов на регистрации без согласования (если в течение 15 дней заявитель не предоставит своих замечаний к ним)
Нормативные акты, регулирующие процедуру:
- Закон Украины «О лекарственных средствах» (ст. 9)
- Постановление КМУ от 26.05.2005 г. № 376 «Об утверждении Порядка государственной регистрации (перерегистрации) лекарственных средств и размеров сбора за их государственную регистрацию (перерегистрацию)»
- Приказ Минздрава от 26.08.2005 г. № 426«Об утверждении Порядка проведения экспертизы регистрационных материалов на лекарственные средства, направляемые на государственную регистрацию (перерегистрацию), а также экспертизы материалов о внесении изменений в регистрационные материалы на протяжении действия регистрационного удостоверения»
Если у Вас возникли вопросы, Вы можете задать нам их, написав на почту или позвонив.
Свяжитесь с нами по почте [email protected], по номеру телефона +38 044 499 47 99 или заполнив форму:Мы готовы Вам помочь!
Мы готовы Вам помочь!
Свяжитесь с нами по почте [email protected], по номеру телефона +38 044 499 47 99 или заполнив форму: