Реєстрація лікарських засобів: документи, порядок, можливі проблеми

1. Які ліки потрібно реєструвати?
Реєструвати необхідно всі ліки, які виробляються та / або ввозяться на територію України.Не потрібно реєструвати тільки ліки, які виготовляються:
в аптеках за рецептами лікарів (магістральними формулами);на замовлення лікувально-профілактичних закладів (за офіційними формулами).
2. Документи, які необхідні для реєстрації
Перелік документів, необхідних для реєстрації ліків залежить від того, що це за ліки, і чи збирається заявник реєструвати активний фармацевтичний інгредієнт (АФІ) або діючу речовину, що міститься в ньому, одночасно з реєстрацією цих ліків. Залежно від цього розрізняють три види заяв про реєстрацію та, відповідно, три переліки документів, які до них додаються (при цьому конкретний перелік документів також залежить від виду ліків і умов їх реєстрації: у багатьох випадках деякі з нижчеперелічених документів не потрібні).
| Заява за формою №1 (ЗАВАНТАЖИТИ) |
Заява за формою №2 (ЗАВАНТАЖИТИ) |
Заява за формою №3 (ЗАВАНТАЖИТИ) |
| Використовується для реєстрації лікарських засобів, у тому числі, імунобіологічних препаратів за повною процедурою |
Використовується для реєстрації традиційних ліків і ліків, які виробляються за затвердженими прописами |
Використовується для реєстрації АФІ чи діючої речовини ліків |
Перелік документів, що додаються:
|
Перелік документів, що додаються:
|
Перелік документів, що додаються:
|
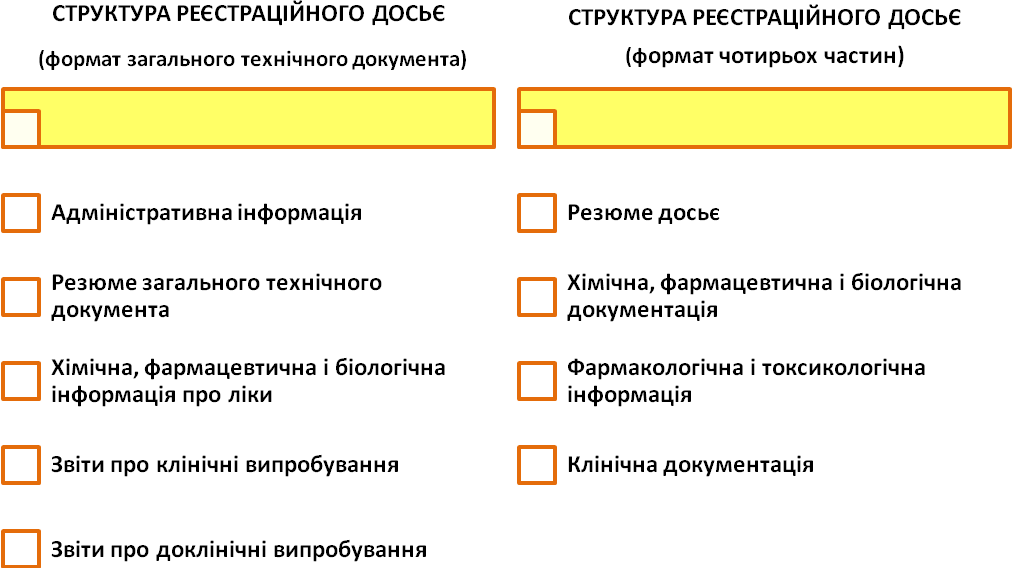
Для проведення експертизи, на підставі заяви, листа-направлення та рекомендацій МОЗ, заявник повинен подати реєстраційне досьє на ліки. Реєстраційне досьє залежно від виду ліків і рекомендацій МОЗ може подаватися в одному з двох форматів:
3. Порядок реєстрації
3.1. Подача заяви та її перевірка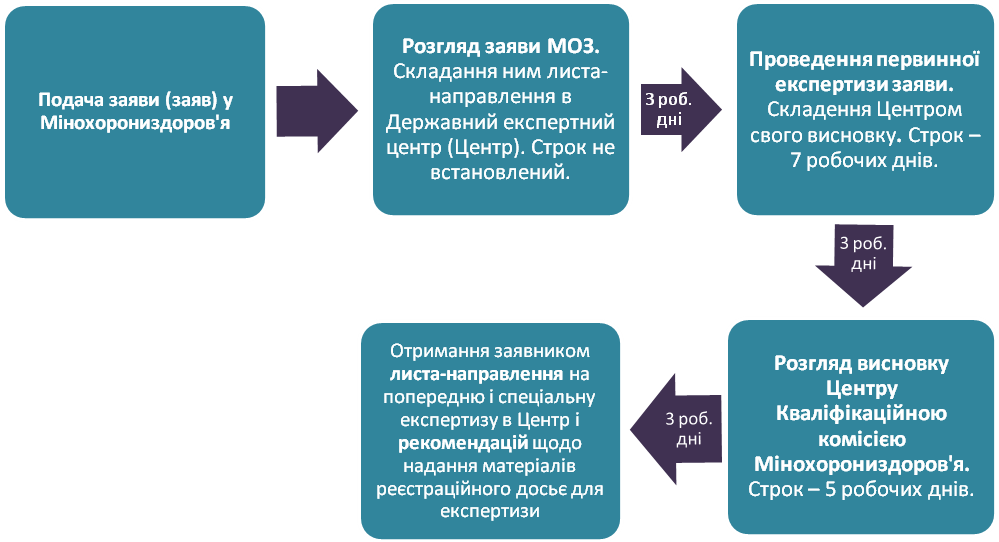
Можливі проблеми:
- затримки з термінами розгляду і передачі документів від МОЗ до Центру, з Центру до МОЗ, від МОЗ - заявнику;
- відмова в реєстрації ліків з причини внесення їх до переліку ліків, заборонених до використання;
- встановлення факту невідповідності заяви встановленим вимогам.
3.2. Підготовка і проведення експертизи ліків
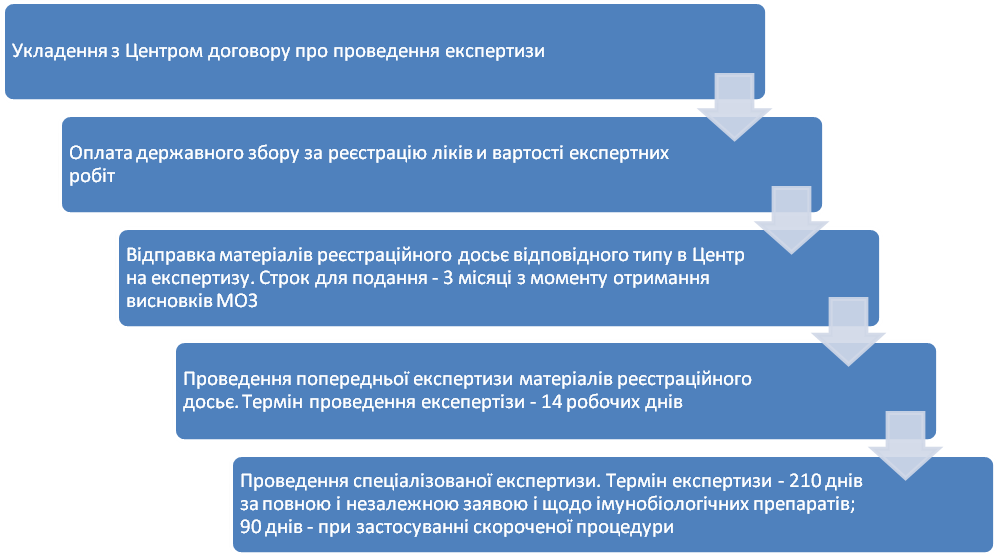
Можливі проблеми:
- продовження строків проведення попередньої експертизи при необхідності надати додаткові дані та / або інформацію (термін надання додаткових матеріалів - 90 робочих днів);
- призначення додаткових випробувань та / або додаткової експертизи (оплачуються окремо);
|
! |
Час, необхідний для підготовки і подання додаткових даних та / або інформації, а також для проведення додаткових випробувань (експертиз) не входить до строку проведення попередньої експертизи. |
- відмова в реєстрації ліків. Причини:
а) прострочення терміну подачі матеріалів реєстраційного досьє на експертизу;
б) невідповідність матеріалів реєстраційного досьє встановленим вимогам;
в) ненадання у встановлений термін додаткових матеріалів та / або інформації;
|
! |
При відмові в реєстрації ліків реєстраційний збір та вартість експертних робіт не повертаються. |
- отримання негативного висновку за результатами спеціалізованої експертизи і, як наслідок, відмова в реєстрації. Пдстави:
а) ліки шкідливі для здоров'я та / або їх терапевтична ефективність відсутня;
б) склад ліків не відповідає заявленому;
в) матеріали реєстраційного досьє не відповідають встановленим вимогам;
г) встановлено факт неправомірного використання або посилання на інформацію щодо ефективності та безпеки референтних / оригінальних ліків, що містять ту саму діючу речовину, протягом перших 5 років з дати реєстрації таких ліків;
д) внаслідок реєстрації будуть порушені захищені патентом чинні майнові права інтелектуальної власності.
3.3. Видача реєстраційного посвідчення


Можливі проблеми:
- затримка строків видачі реєстраційних документів;
- відправка проектів документів на реєстрацію без узгодження (якщо протягом 15 днів заявник не надасть своїх зауважень до них).
Нормативні акти, які регулюють процедуру:
- Закон України «Про лікарські засоби» (ст. 9)
- Постанова КМУ від 26.05.2005 р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)»
- Наказ МОЗ від 26.08.2005 р. № 426 «Про затвердження Порядку проведення експертизи реєстраційних матеріалів на лікарські засоби, що направляються на державну реєстрацію (перереєстрацію), а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення»
Зв'яжіться з нами через пошту [email protected], за номером телефону +38 044 499 47 99 чи через форму:Ми готові Вам допомогти!
Ми готові Вам допомогти!
Зв'яжіться з нами через пошту [email protected], за номером телефону +38 044 499 47 99 чи через форму: